Termodinamikada tizimning dastlabki holatidan oxirgi holatiga oʻtishni oʻrganishda jarayonning issiqlik effektini bilish muhim ahamiyatga ega. Issiqlik sig'imi tushunchasi bu ta'sir bilan chambarchas bog'liq. Ushbu maqolada biz gazning izoxorik issiqlik sig'imi deganda nimani anglatadi, degan savolni ko'rib chiqamiz.
Ideal gaz
Ideal gaz - zarralari moddiy nuqtalar hisoblangan, ya'ni o'lchamlari bo'lmagan, lekin massaga ega bo'lgan va barcha ichki energiya faqat molekulalar harakatining kinetik energiyasidan iborat bo'lgan gazdir. va atomlar.
Har qanday haqiqiy gaz hech qachon tasvirlangan modelni ideal tarzda qondira olmaydi, chunki uning zarralari hali ham ba'zi chiziqli o'lchamlarga ega va zaif van der Waals bog'lari yoki boshqa turdagi kimyoviy bog'lanishlar yordamida bir-biri bilan o'zaro ta'sir qiladi. Biroq, past bosim va yuqori haroratlarda molekulalar orasidagi masofalar katta bo'lib, ularning kinetik energiyasi potensial energiyadan o'nlab marta oshadi. Bularning barchasi haqiqiy gazlar uchun ideal modelni yuqori aniqlik bilan qo'llash imkonini beradi.
Gazning ichki energiyasi
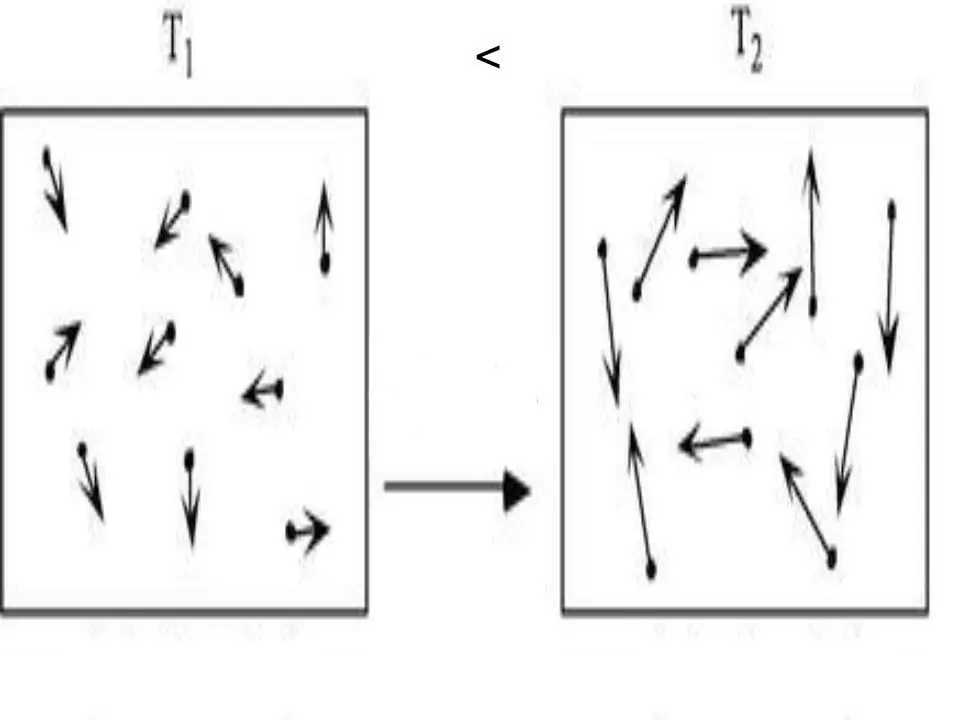
Har qanday tizimning ichki energiyasi fizik xususiyat boʻlib, u potensial va kinetik energiya yigʻindisiga teng. Ideal gazlarda potentsial energiyani e'tiborsiz qoldirish mumkin bo'lganligi sababli ular uchun tenglikni yozishimiz mumkin:
U=Ek.
Bu yerda Ek - kinetik sistemaning energiyasi. Molekulyar-kinetik nazariyadan foydalanib va universal Klapeyron-Mendeleyev holat tenglamasini qo‘llagan holda, U uchun ifodani olish qiyin emas. Quyida yozilgan:
U=z/2nRT.
Bu yerda T, R va n mos ravishda mutlaq harorat, gaz konstantasi va moddaning miqdori. z-qiymati gaz molekulasining erkinlik darajalari sonini bildiruvchi butun sondir.
Izobarik va izoxorik issiqlik sigimi
Fizikada issiqlik sig'imi - bu o'rganilayotgan tizimni bir kelvinga qizdirish uchun unga berilishi kerak bo'lgan issiqlik miqdori. Teskari ta'rif ham to'g'ri, ya'ni issiqlik sig'imi tizim bir kelvin sovutganda chiqaradigan issiqlik miqdoridir.
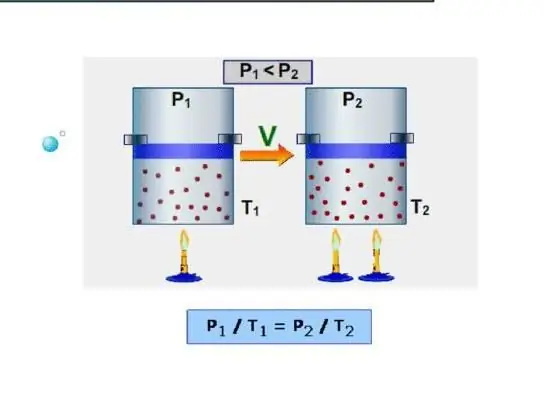
Tizimning eng oson yo'li izoxorik issiqlik sig'imini aniqlashdir. Bu doimiy hajmdagi issiqlik sig'imi deb tushuniladi. Tizim bunday sharoitlarda ishni bajarmaganligi sababli, barcha energiya ichki energiya zahiralarini oshirishga sarflanadi. Izoxorik issiqlik sig'imini CV belgisi bilan belgilaymiz, keyin quyidagicha yozishimiz mumkin:
dU=CVdT.
Ya'ni ichki energiyaning o'zgarishitizim uning haroratining o'zgarishiga to'g'ridan-to'g'ri proportsionaldir. Agar bu ifodani oldingi paragrafda yozilgan tenglik bilan solishtirsak, ideal gazda CV formulasiga erishamiz:
SV=z/2nR.
Bu qiymatdan amalda foydalanish noqulay, chunki u tizimdagi moddaning miqdoriga bogʻliq. Shuning uchun o'ziga xos izoxorik issiqlik sig'imi tushunchasi kiritildi, ya'ni 1 mol gaz uchun yoki 1 kg uchun hisoblangan qiymat. Birinchi qiymatni CV belgisi bilan, ikkinchisini CV belgisi bilan belgilaymiz. m. Ular uchun siz quyidagi formulalarni yozishingiz mumkin:
CV=z/2R;
CVm=z/2R/M.
Bu yerda M molyar massa.
Izobarik - tizimda doimiy bosimni saqlab turganda issiqlik sig'imi. Bunday jarayonga misol qilib, qizdirilganda piston ostidagi silindrdagi gazning kengayishini keltirish mumkin. Izobarik jarayondan farqli o'laroq, izobar jarayonda tizimga berilgan issiqlik ichki energiyani oshirish va mexanik ishlarni bajarish uchun sarflanadi, ya'ni:
H=dU + PdV.
Izobar jarayonning entalpiyasi izobar issiqlik sig'imi va tizimdagi harorat o'zgarishining mahsulotidir, ya'ni:
H=CPdT.
Agar 1 mol gazning doimiy bosimida kengayishni hisobga olsak, u holda termodinamikaning birinchi qonuni quyidagicha yoziladi:
CPdT=CV dT + RdT.
Oxirgi had tenglamadan olinganKlapeyron-Mendeleev. Bu tenglikdan izobar va izoxorik issiqlik sig'imlari o'rtasidagi munosabat kelib chiqadi:
CP=CV + R.
Ideal gaz uchun doimiy bosimdagi solishtirma molyar issiqlik sigʻimi har doim R=8, 314 J/(molK) mos izoxorik xarakteristikasidan katta boʻladi.
Molekulalarning erkinlik darajalari va issiqlik sig'imi
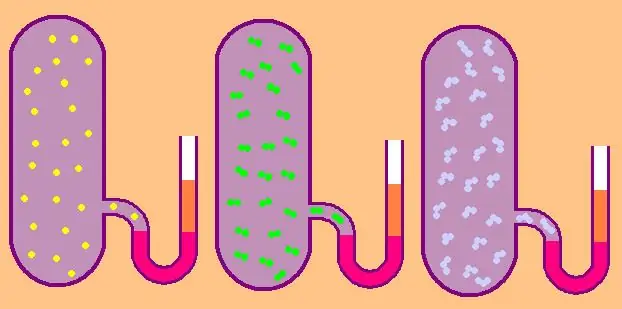
Keling, xususiy molyar izoxorik issiqlik sig'imi formulasini yana yozamiz:
CV=z/2R.
Monaatomik gazda z=3 qiymati, chunki kosmosdagi atomlar faqat uchta mustaqil yo'nalishda harakatlana oladi.
Agar biz ikki atomli molekulalardan tashkil topgan gaz haqida gapiradigan bo'lsak, masalan, kislorod O2 yoki vodorod H2, u holda, translatsiya harakatidan tashqari, bu molekulalar hali ham ikkita o'zaro perpendikulyar o'q atrofida aylanishi mumkin, ya'ni z 5 ga teng bo'ladi.
Koʻproq murakkab molekulalar uchun z=6 dan foydalaning.V
aniqlash uchun






