Statistik tizimlarda sodir boʻladigan jarayonlarni oʻrganish zarrachalarning minimal oʻlchamlari va ularning koʻp sonliligi bilan murakkablashadi. Har bir zarrachani alohida ko'rib chiqish deyarli mumkin emas, shuning uchun statistik miqdorlar kiritiladi: zarrachalarning o'rtacha tezligi, ularning konsentratsiyasi, zarracha massasi. Mikroskopik parametrlarni hisobga olgan holda tizim holatini tavsiflovchi formula gazlarning molekulyar-kinetik nazariyasining (MKT) asosiy tenglamasi deb ataladi.
Oʻrtacha zarracha tezligi haqida bir oz
Zarrachalar tezligini aniqlash birinchi marta eksperimental tarzda amalga oshirilgan. Otto Stern tomonidan o'tkazilgan maktab o'quv dasturidan taniqli eksperiment zarrachalarning tezligi haqida g'oyani yaratishga imkon berdi. Tajriba davomida kumush atomlarining aylanadigan tsilindrlardagi harakati o'rganildi: birinchi navbatda, o'rnatishning statsionar holatida, keyin u ma'lum bir burchak tezligi bilan aylanganda.
Natijada kumush molekulalarining tezligi tovush tezligidan oshib, 500 m/s ekanligi aniqlandi. Fakt juda qiziq, chunki odam moddalardagi zarrachalar harakatining bunday tezligini his qilishi qiyin.
Ideal gaz
Tadqiqotni davom ettiringBu faqat fizik asboblar yordamida parametrlari to'g'ridan-to'g'ri o'lchovlar bilan aniqlanishi mumkin bo'lgan tizimda mumkin ko'rinadi. Tezlik spidometr bilan o'lchanadi, ammo spidometrni bitta zarrachaga ulash g'oyasi bema'ni. Faqat zarracha harakati bilan bog'liq makroskopik parametrni to'g'ridan-to'g'ri o'lchash mumkin.
Gaz bosimini hisobga oling. Idishning devorlariga bosim idishdagi gaz molekulalarining ta'siridan hosil bo'ladi. Moddaning gaz holatining o'ziga xos xususiyati zarralar orasidagi etarlicha katta masofada va ularning bir-biri bilan kichik o'zaro ta'sirida. Bu bosimni bevosita oʻlchash imkonini beradi.
Har qanday oʻzaro taʼsir qiluvchi jismlar tizimi harakatning potentsial energiyasi va kinetik energiyasi bilan tavsiflanadi. Haqiqiy gaz murakkab tizimdir. Potensial energiyaning o'zgaruvchanligi tizimlashtirishga mos kelmaydi. Muammoni o'zaro ta'sirning murakkabligini chetga surib, gazning xarakterli xususiyatlarini o'z ichiga olgan modelni joriy etish orqali hal qilish mumkin.
Ideal gaz - zarrachalarning o'zaro ta'siri ahamiyatsiz bo'lgan, o'zaro ta'sirning potentsial energiyasi nolga moyil bo'lgan moddaning holati. Faqat zarrachalar tezligiga bog'liq bo'lgan harakat energiyasini muhim deb hisoblash mumkin.
Ideal gaz bosimi
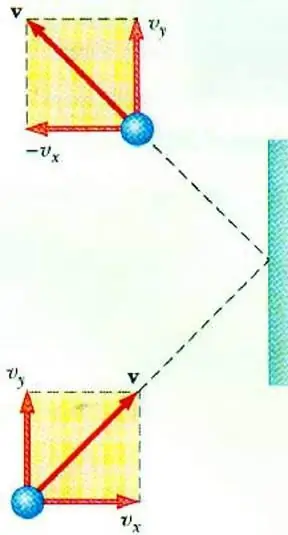
Gaz bosimi va uning zarrachalarining tezligi o'rtasidagi bog'liqlikni ochib berish ideal gazning MKT ning asosiy tenglamasini yaratishga imkon beradi. Idishda harakatlanayotgan zarracha devorga urilganda unga impulsni uzatadi, uning qiymati ikkinchi qonun asosida aniqlanishi mumkin. Nyuton:
F∆t=2m0vx
Elastik ta'sir paytida zarracha impulsining o'zgarishi uning tezligining gorizontal komponentining o'zgarishi bilan bog'liq. F - zarracha tomondan devorga qisqa vaqt davomida ta'sir qiluvchi kuch t; m0 - zarracha massasi.
Barcha gaz zarralari S maydon yuzasi bilan ∆t vaqt davomida to’qnashadi, sirt yo’nalishi bo’yicha vx tezlik bilan harakatlanadi va Sy hajmli silindrda joylashadi. x Dt. Zarrachalar kontsentratsiyasi n bo'lganda, molekulalarning aynan yarmi devor tomon harakatlanadi, qolgan yarmi esa teskari yo'nalishda harakat qiladi.
Barcha zarrachalarning toʻqnashuvini koʻrib chiqib, maydonga taʼsir etuvchi kuch uchun Nyuton qonunini yozishimiz mumkin:
F∆t=nm0vx2S∆t
Gaz bosimi sirtga perpendikulyar ta'sir qiluvchi kuchning ikkinchisining maydoniga nisbati sifatida aniqlanganligi sababli, biz yozishimiz mumkin:
p=F: S=nm0vx2
MKT ning asosiy tenglamasi sifatida hosil boʻlgan munosabat butun tizimni tavsiflay olmaydi, chunki harakatning faqat bitta yoʻnalishi hisobga olinadi.
Maksvell taqsimoti
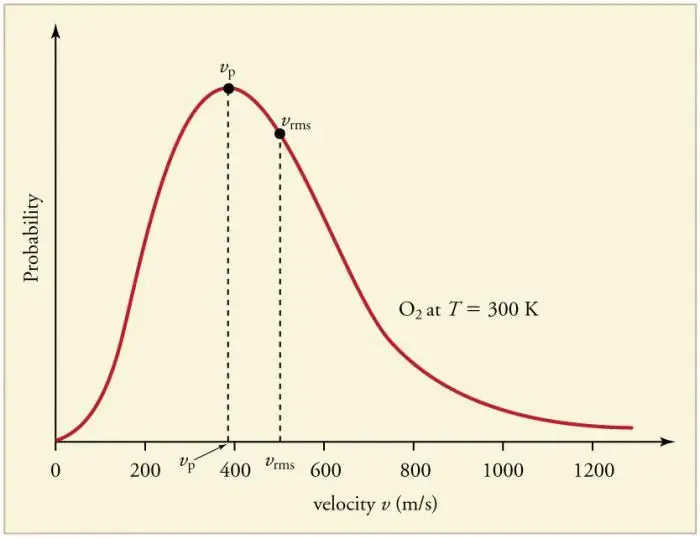
Gaz zarralarining devorlari va bir-biri bilan uzluksiz tez-tez toʻqnashuvi zarrachalarning tezliklar (energiyalar) boʻyicha maʼlum statistik taqsimotini oʻrnatishga olib keladi. Barcha tezlik vektorlarining yo'nalishlari bir xil ehtimolli bo'lib chiqadi. Ushbu taqsimot Maksvell taqsimoti deb ataladi. 1860 yilda bu naqsh ediMKT asosida J. Maksvell tomonidan olingan. Tarqatish qonunining asosiy parametrlari tezliklar deb ataladi: ehtimol, egri chiziqning maksimal qiymatiga mos keladi va o'rtacha kvadrat vkv=√‹v2 › - zarracha tezligining oʻrtacha kvadrati.
Gaz haroratining oshishi tezlikning oshishiga mos keladi.
Barcha tezliklar teng va ularning modullari bir xil qiymatga ega ekanligiga asoslanib, biz quyidagilarni taxmin qilishimiz mumkin:
‹v2›=‹vx2› + ‹v y2› + ‹vz2›, dan: ‹ vx2›=‹v2›: 3
Gaz bosimining o'rtacha qiymatini hisobga olgan holda MKT ning asosiy tenglamasi:
p=nm0‹v2›: 3.
Bu bogʻliqlik mikroskopik parametrlar: tezlik, zarracha massasi, zarracha kontsentratsiyasi va umuman gaz bosimi oʻrtasidagi bogʻliqlikni aniqlashi bilan oʻziga xosdir.
Zarralarning kinetik energiyasi tushunchasidan foydalanib, MKT ning asosiy tenglamasini boshqacha yozish mumkin:
p=2nm0‹v2›: 6=2n‹Ek›: 3
Gaz bosimi uning zarralari kinetik energiyasining oʻrtacha qiymatiga mutanosib.
Harorat
Qizigʻi shundaki, yopiq idishdagi gazning doimiy miqdori uchun gaz bosimi va zarracha harakat energiyasining oʻrtacha qiymatini bogʻlash mumkin. Bunday holda, bosimni energiyani o'lchash orqali o'lchash mumkinzarralar.
Nima qilish kerak? Kinetik energiya bilan qanday qiymatni solishtirish mumkin? Harorat shunday qiymatga aylandi.

Harorat moddalarning issiqlik holatining oʻlchovidir. Uni o'lchash uchun termometr ishlatiladi, uning asosi qizdirilganda ishlaydigan suyuqlikning (spirtli ichimliklar, simob) termal kengayishi hisoblanadi. Termometr shkalasi eksperimental tarzda yaratilgan. Odatda, doimiy termal holatda (qaynoq suv, muzning erishi) sodir bo'ladigan ba'zi fizik jarayonlarda ishchi suyuqlikning holatiga mos keladigan belgilar qo'yiladi. Turli xil termometrlar turli xil o'lchovlarga ega. Masalan, Selsiy, Farengeyt.

Universal harorat shkalasi
Gaz termometrlarini ishchi suyuqlik xususiyatlaridan mustaqillik nuqtai nazaridan qiziqroq deb hisoblash mumkin. Ularning ko'lami ishlatiladigan gaz turiga bog'liq emas. Bunday qurilmada gaz bosimi nolga moyil bo'lgan haroratni taxminiy ravishda ajratib ko'rsatish mumkin. Hisob-kitoblar shuni ko'rsatadiki, bu qiymat -273,15 oC ga to'g'ri keladi. Harorat shkalasi (mutlaq harorat shkalasi yoki Kelvin shkalasi) 1848 yilda kiritilgan. Ushbu shkalaning asosiy nuqtasi sifatida nol gaz bosimining mumkin bo'lgan harorati qabul qilindi. Shkalaning birlik segmenti Selsiy shkalasining birlik qiymatiga teng. Gaz jarayonlarini o‘rganishda haroratdan foydalangan holda asosiy MKT tenglamasini yozish qulayroq ko‘rinadi.
Bosim va harorat oʻrtasidagi bogʻliqlik
Buni empirik tarzda tekshirishingiz mumkingaz bosimining uning haroratiga mutanosibligi. Shu bilan birga, bosim zarrachalar kontsentratsiyasiga to'g'ridan-to'g'ri proportsional ekanligi aniqlandi:
P=nkT,
bu yerda T mutlaq harorat, k 1,38•10-23J/K ga teng doimiy.
Barcha gazlar uchun doimiy qiymatga ega boʻlgan asosiy qiymat Boltsman doimiysi deb ataladi.
Bosimning haroratga bogʻliqligini va MKT gazlarining asosiy tenglamasini solishtirib, yozishimiz mumkin:
‹Ek›=3kT: 2
Gaz molekulalari harakatining kinetik energiyasining o'rtacha qiymati uning haroratiga proportsionaldir. Ya'ni, harorat zarracha harakatining kinetik energiyasining o'lchovi bo'lib xizmat qilishi mumkin.






