Aldegidlar -CH funktsional guruhini o'z ichiga olgan karbonil birikmalariga tegishli organik moddalar bo'lib, ular karbonil guruhi deb ataladi.
Molekulaning uglevodorod skeletining tabiatiga koʻra aldegidlar toʻyingan, toʻyinmagan va aromatik boʻladi. Ularning molekulalari halogen atomlarini yoki qo'shimcha funktsional guruhlarni ham o'z ichiga olishi mumkin. Toʻyingan aldegidlarning umumiy formulasi C H2 O. IUPAC nomenklaturasiga muvofiq, ularning nomlari -al.
qo`shimchasi bilan tugaydi.
Aldegidlarning oksidlanishi sanoatda muhim ahamiyatga ega, chunki ular osonlik bilan karboksilik kislotalarga aylanadi. Bunday holda mis gidroksidi, kumush oksidi yoki hatto atmosfera kislorodi oksidlovchi moddalar sifatida xizmat qilishi mumkin.
Karbonil guruhining tuzilishi
C=O guruhidagi qo’sh bog’lanishning elektron tuzilishi bitta s-bog’ va yana bitta p-bog’ning hosil bo’lishi bilan tavsiflanadi. Atom C sp2-gibridlanish holatida, tekis molekula boʻlib, bogʻlanishlar orasidagi bogʻlanish burchaklari taxminan 1200. Ushbu funktsional guruhdagi qo'sh bog'lanishning farqi shundaki, u uglerod atomi va yuqori elektronegativ kislorod atomi o'rtasida joylashgan. Natijadaelektronlar O atomiga tortiladi, ya'ni bu bog'lanish juda kuchli qutblangan.
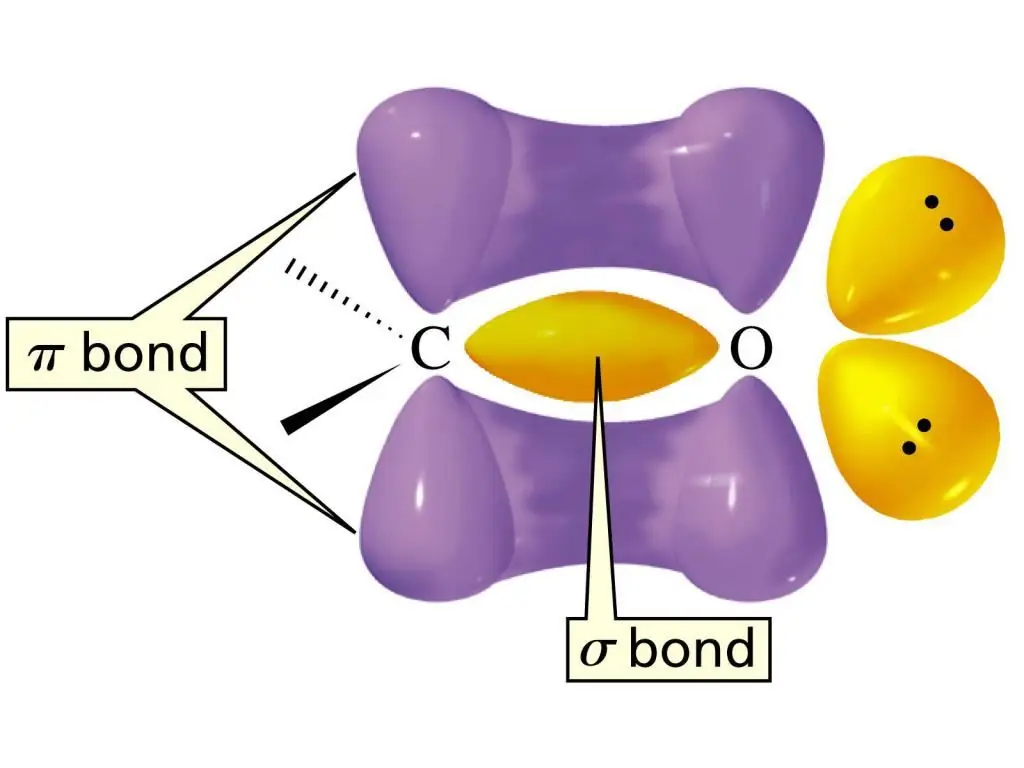
Aldegidlar guruhidagi bunday qutblangan qoʻsh bogʻlanishni aldegidlarning yuqori reaktivligining asosiy sababi deb atash mumkin. Aldegidlar uchun atomlarning yoki ularning guruhlarining C=O bog`lanishiga qo`shilish reaksiyalari eng xarakterlidir. Nukleofil qo'shilish reaktsiyalari esa eng oson davom etadi. Aldegidlar uchun funksional aldegidlar guruhidagi H atomlari ishtirokidagi reaksiyalar ham xosdir. C=O guruhining elektronni tortib olish effekti tufayli bog'lanishning qutbliligi ortadi. Bu, o'z navbatida, aldegidlarning nisbatan oson oksidlanishiga sababdir.
Aldegidlarning ayrim vakillari
Formaldegid (formaldegid yoki metanal) CH2O juda oʻtkir hidli gazsimon modda boʻlib, odatda metanol bugʻining havo bilan aralashmasini qizil rangdan oʻtkazish yoʻli bilan olinadi. - mis yoki kumush to'rning issiq to'rlari. Uning 40% li suvli eritmasi formalin deb ataladi. Formaldegid osonlikcha reaktsiyalarga kiradi, ularning ko'pchiligi bir qator muhim moddalarning sanoat sintezi asosida yotadi. Bundan tashqari, izopren kauchuk, pentaeritrit, ko'plab dorivor moddalar, turli bo'yoqlar olish uchun, terini ko'nlash uchun, dezinfektsiyalovchi va dezodorant sifatida ishlatiladi. Formaldegid juda zaharli, uning havodagi MPC si 0,001 mg/l.
Asetaldegid (sirka aldegidi, etanal) CH3SON - bo'g'uvchi hidli rangsiz suyuqlik bo'lib, suv bilan suyultirilganda hosil bo'ladi.mevali xushbo'y. Asetaldegid aldegidlarning barcha asosiy xususiyatlariga ega. Asetaldegidning oksidlanishi natijasida juda ko'p miqdorda sirka kislotasi va sirka angidrid, turli farmatsevtik preparatlar hosil bo'ladi.
Akrolein (propenal) CH2=CH-SON, eng oddiy toʻyinmagan aldegid rangsiz, uchuvchi suyuqlikdir. Uning bug'lari ko'z va yuqori nafas yo'llarining shilliq pardalarini kuchli bezovta qiladi. Juda zaharli, havodagi MPC miqdori 0,7 mg/m3. Propenal ma'lum polimerlar sintezidagi oraliq mahsulot bo'lib, ba'zi dorilarni ishlab chiqarishda talab qilinadi.

Benzaldegid (benzoy aldegid) S6N5SON - rangsiz suyuqlik, saqlash vaqtida sarg'ayib, achchiq bodom ta'miga ega. U havoda tez oksidlanib, benzoy kislotasiga aylanadi. O'simliklarning efir moylarida (neroli, pachuli) va glyukozid shaklida - achchiq bodom, gilos, o'rik va shaftoli urug'lari yadrolarida mavjud. Xushbo'y modda sifatida parfyumeriyada, oziq-ovqat essensiyalarining tarkibiy qismi sifatida, boshqa xushbo'y moddalar (cinnamaldegid, jasminaldegid) sintezi uchun xom ashyo sifatida ishlatiladi.
Kumush oyna reaktsiyasi
Aldegidlarning kumush oksidi bilan oksidlanishi funksional guruhning tegishli shakliga eng muhim sifatli reaksiya hisoblanadi. Bu reaksiya probirka devorlaridagi yupqa kumush qoplama tufayli o'z nomini oldi, bu reaksiya jarayonida hosil bo'ladi.
Uning mohiyati R-COH aldegidining ammiak oksidi eritmasi bilan oʻzaro taʼsiridadir.kumush(I), bu eruvchan kompleks birikma [Ag(NH3)2]OH va Tollens reaktivi deb ataladi. Reaktsiya suvning qaynash nuqtasiga (80-100 ° C) yaqin haroratlarda amalga oshiriladi. Bunda aldegidlar tegishli karboksilik kislotalargacha oksidlanadi va oksidlovchi modda cho‘kma hosil qiluvchi metall kumushga qaytariladi.
Reagentlar tayyorlash
Aldegidlardagi -SON guruhini sifat jihatidan aniqlash uchun avval kumush kompleks birikmasi tayyorlanadi. Buning uchun probirkaga ammiakning suvdagi ozroq eritmasi (ammiak gidroksid) quyiladi, keyin oz miqdorda kumush nitrat quyiladi. Bunday holda, kumush oksidning hosil bo'lgan cho'kmasi darhol yo'qoladi:
2AgNO3 + 2NH3 + H2O -> Ag 2O↓ + 2NH4NO3
Ag2O + 4N3 + l2O -> 2[Ag (NO3)2]O
Ishqor bilan tayyorlangan Tollens reaktivi yanada ishonchli natijalar beradi. Buning uchun 1 g AgNO3 10 g distillangan suvda eritiladi va unga teng miqdorda konsentrlangan natriy gidroksid qo’shiladi. Natijada Ag2O cho’kmasi hosil bo’lib, konsentrlangan ammoniy gidroksid eritmasi qo’shilganda yo’qoladi. Reaksiya uchun faqat yangi tayyorlangan reagentdan foydalanish kerak.

Reaktsiya mexanizmi
Kumush oynaning reaksiyasi tenglamaga mos keladi:
2[Ag(NO3)2]OΗ + NSOΗ-> 2Ag↓ + ΗCOONE4 + 3NO3 + H2O
Ta’kidlash joizki, aldegidlar uchun bu o’zaro ta’sir yetarlicha o’rganilmagan. Ushbu reaksiyaning mexanizmi noma'lum, ammo radikal yoki ionli oksidlanish varianti taxmin qilinadi. Diamminekumush gidroksidi katta ehtimol bilan diolning kumush tuzi hosil bo'lishi bilan qo'shilib, undan kumush ajralib, karboksilik kislota hosil qiladi.
Idishlarning tozaligi tajribani muvaffaqiyatli o'tkazish uchun juda muhimdir. Buning sababi shundaki, tajriba davomida hosil bo'lgan kolloid kumush zarralari oyna yuzasiga yopishib, oyna yuzasini hosil qilishi kerak. Kichkina ifloslanish bo'lsa, u kulrang flokulyant cho'kma shaklida cho'kadi.
Idishni tozalash uchun ishqorli eritmalardan foydalanish kerak. Shunday qilib, bu maqsadlar uchun siz ko'p miqdorda distillangan suv bilan yuvilishi kerak bo'lgan NaOH eritmasini olishingiz mumkin. Shisha yuzasida yog 'va mexanik zarralar bo'lmasligi kerak.
Mis gidroksid bilan oksidlanish
Aldegidlarning mis (II) gidroksid bilan oksidlanish reaksiyasi ham funksional guruh turini aniqlashda ancha samarali va samarali hisoblanadi. U reaksiya aralashmasining qaynashiga mos keladigan haroratda davom etadi. Shu bilan birga, aldegidlar Feling reaktividagi ikki valentli misni (Cu(OH)2 ning yangi tayyorlangan ammiak eritmasi) bir valentli misga kamaytiradi. Ularning o'zi C-H bog'iga kislorod atomining kiritilishi tufayli oksidlanadi (C ning oksidlanish darajasi +1 dan +3 gacha o'zgaradi).
Vizual ravishda harakat orqasidareaktsiyalarni eritmalar aralashmasi rangini o'zgartirish orqali kuzatish mumkin. Mis gidroksidning mavimsi cho'kmasi asta-sekin sarg'ayadi, bu bir valentli mis gidroksidiga mos keladi va keyingi yorqin qizil cho'kma Cu2O.
Bu jarayon reaksiya tenglamasiga mos keladi:
R-SLEEP + Cu2+ + NaOH + H2O -> R-COONa + Cu 2O + 4H+

Jons reaktivi bilan harakat
Ta'kidlash joizki, bunday reaktiv aldegidlarga eng yaxshi ta'sir qiladi. Bunday holda, oksidlanish isitishni talab qilmaydi va 0-20 ° S haroratda juda qisqa vaqt ichida amalga oshiriladi va mahsulotlarning rentabelligi 80% dan ortiq. Jons reaktivining asosiy kamchiligi boshqa funktsional guruhlar uchun yuqori selektivlikning yo'qligi va bundan tashqari, kislotali muhit ba'zan izomerlanish yoki yo'q qilishga olib keladi.
Jons reaktivi xrom (VI) oksidining suyultirilgan sulfat kislota va asetondagi eritmasi. Uni natriy dixromatdan ham olish mumkin. Aldegidlar oksidlanganda ushbu reaktiv ta'sirida karboksilik kislotalar hosil bo'ladi.
Sanoat kislorodining oksidlanishi
Sanoatda atsetaldegidning oksidlanishi katalizatorlar - kob alt yoki marganets ionlari ishtirokida kislorod ta'sirida amalga oshiriladi. Perasetik kislota avval hosil bo'ladi:
CH3-UYQU + O2 -> CH3-UNOH
U, oʻz navbatida, atsetaldegidning ikkinchi molekulasi va peroksid orqali oʻzaro taʼsir qiladi.birikma ikki molekula sirka kislotasini beradi:
CH3-COOH + CH3-SON -> 2CH3-COOH
Oksidlanish 60-70 °C haroratda va 2 105 Pa bosimda amalga oshiriladi.
Yod eritmasi bilan oʻzaro taʼsiri
Aldegid guruhlarini oksidlash uchun ba'zan ishqor ishtirokida yod eritmasi qo'llaniladi. Ushbu reagent uglevod oksidlanish jarayonida alohida ahamiyatga ega, chunki u juda tanlab ta'sir qiladi. Shunday qilib, uning ta'siri ostida D-glyukoza D-glyukon kislotasiga aylanadi.
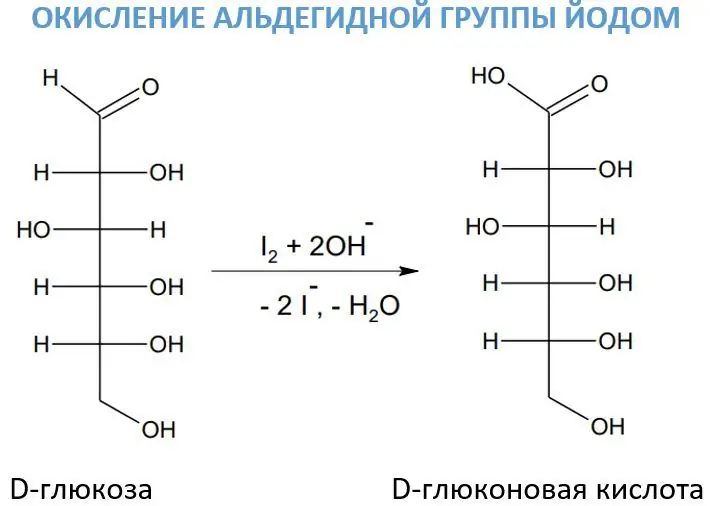
Yod ishqorlar ishtirokida gipoiodid (juda kuchli oksidlovchi modda) hosil qiladi:.
Gipiodid ta'sirida formaldegid metan kislotasiga aylanadi: DESO + NaIO + NaOΗ -> DECOONa + NaI + H2O.
Aldegidlarning yod bilan oksidlanishi analitik kimyoda ularning eritmalardagi miqdoriy tarkibini aniqlash uchun ishlatiladi.
Selen dioksidi bilan oksidlanish
Avvalgi reagentlardan farqli ravishda selen dioksidi taʼsirida aldegidlar dikarbonil birikmalarga aylanadi, formaldegiddan glyoksal hosil boʻladi. Agar metilen yoki metil guruhlari karbonil yonida joylashgan bo'lsa, ular karbonilga aylanishi mumkin. SeO2 uchun erituvchi sifatida odatda dioksan, etanol yoki ksilen ishlatiladi.
Bir usulga ko'ra, reaksiya aralashtirgich, termometr va qayta oqim kondensatoriga ulangan uch bo'yinli kolbada olib boriladi. 0,25 mol miqdorida olingan boshlang'ich materialga tomchilab eritma qo'shiladi180 ml dioksanda 0,25 mol selen dioksidi, shuningdek, 12 ml H2O. Harorat 20 ° C dan oshmasligi kerak (agar kerak bo'lsa, kolbani sovutib oling). Shundan so'ng, doimiy aralashtirish bilan eritma 6 soat davomida qaynatiladi. Keyin selenni ajratish uchun issiq eritma filtrlanadi va cho'kma dioksan bilan yuviladi. Erituvchini vakuumli distillashdan keyin qoldiq fraksiyalanadi. Asosiy qism keng harorat oralig'ida (20-30 °C) olinadi va qayta tuzatiladi.
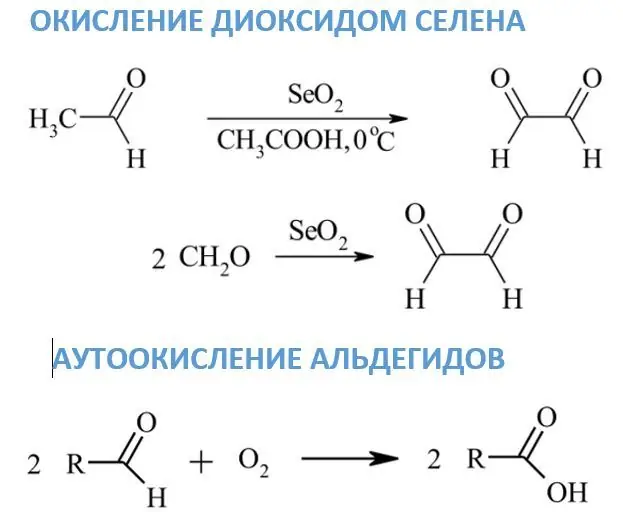
Aldegidlarning avtooksidlanishi
Xona haroratida atmosfera kislorodi ta'sirida aldegidlarning oksidlanishi juda sekin sodir bo'ladi. Ushbu reaksiyalarning asosiy mahsulotlari mos keladigan karboksilik kislotalardir. Avto-oksidlanish mexanizmi etanalning sirka kislotasiga sanoat oksidlanishi bilan bog'liq. Oraliq mahsulotlardan biri boshqa aldegid molekulasi bilan reaksiyaga kirishadigan peratsiddir.
Reaksiyaning bu turi yorug'lik, peroksidlar va og'ir metallar izlari ta'sirida tezlashganligi sababli, uning radikal mexanizmi degan xulosaga kelish mumkin. Suvli eritmalardagi formaldegid havoda o'z hamkasblariga qaraganda ancha yomonroq oksidlanadi, chunki u ularda gidratlangan metilen glikol shaklida mavjud.

Aldegidlarning kaliy permanganat bilan oksidlanishi
Bu reaksiya kislotali muhitda eng muvaffaqiyatli kechadi. Kaliy permanganat eritmasining qizg'inligini yo'qotish va pushti rangining to'liq rangsizlanishi bilan uning o'tishini vizual ravishda baholashingiz mumkin. Reaktsiya sodir bo'ladixona harorati va normal bosim, shuning uchun u maxsus shartlarni talab qilmaydi. Probirkaga 2 ml formaldegid va sulfat kislota bilan kislotalangan kaliy permanganat eritmasidan 1 ml quyish kifoya. Reagentlarni aralashtirish uchun probirkani eritma bilan sekin silkiting:
5CH3-UYQU + 2KMnO4 + 3H2SO 4 =5CH3-COOH + 2MnSO4 + K2SO 4 + 3H2O
Agar xuddi shunday reaksiya yuqori haroratlarda amalga oshirilsa, u holda metanal osongina karbonat angidridga oksidlanadi:
5CH3-UYQU + 4KMnO4 + 6H2SO 4 =5SO2 + 4MnSO4 + 2K2SO 4 + 11N2O






