Tahlilning konduktometrik usuli kimyoviy reaksiyaning borishini kuzatish uchun elektrolitik oʻtkazuvchanlikni oʻlchashdir. Bu fan analitik kimyoda keng qo'llaniladi, bu erda titrlash standart operatsiya usuli hisoblanadi. Kondüktometriya nima? Analitik kimyoda keng tarqalgan amaliyotda bu atama titrlashning sinonimi sifatida ishlatiladi, shu bilan birga u titrlashsiz ilovalarni tasvirlash uchun ham qo'llaniladi. Ushbu tahlil usulidan foydalanishning foydasi nimada? U ko'pincha eritmaning umumiy o'tkazuvchanligini aniqlash yoki ionlar ishtirokidagi titrlashning oxirgi nuqtasini tahlil qilish uchun ishlatiladi.
Tarix
Supero'tkazuvchilarni o'lchash 18-asrda, Andreas Baumgartner Bad Gashteyndagi tuz va mineral suvlarni payqagan paytda boshlangan. Avstriya elektr energiyasini o'tkazadi. Shunday qilib, bugungi kunda suvni tozalash tizimlarining samaradorligini tekshirish uchun tez-tez ishlatiladigan suvning tozaligini aniqlash uchun ushbu usuldan foydalanish 1776 yilda boshlangan. Shunday qilib konduktometrik tahlil usulining tarixi boshlandi.
Fridrix Kolrausch 1860-yillarda suv, kislotalar va boshqa eritmalarga oʻzgaruvchan tokni qoʻllaganida bu fanning rivojlanishini davom ettirdi. Taxminan shu vaqt ichida sulfat kislota va xrom sulfat komplekslarining o'zaro ta'sirini o'rganayotgan Uillis Uitni birinchi kondüktometrik so'nggi nuqtani topdi. Bu topilmalar potentsiometrik titrlash va 1883 yilda Robert Berend tomonidan xlorid va bromid HgNO3 ni titrlashda hajmiy tahlil qilish uchun birinchi asbob bo'lishi bilan yakunlandi. Shunday qilib, tahlilning zamonaviy konduktometrik usuli Berendga asoslangan.
Bu ishlanma tuzlarning eruvchanligini va vodorod ionlarining kontsentratsiyasini, shuningdek kislota-asos va oksidlanish-qaytarilish titrlashlarini tekshirish imkonini berdi. Konduktometrik tahlil usuli 1909 yilda boshlangan shisha elektrodning rivojlanishi bilan takomillashtirildi.
Titration
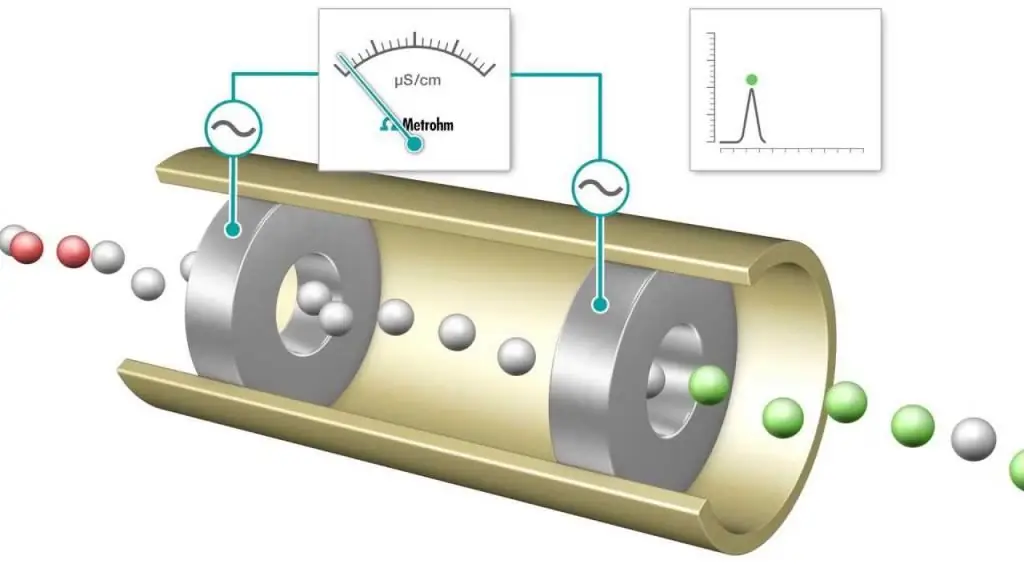
Konduktometrik titrlash - bu reaksiya aralashmasining elektrolitik o'tkazuvchanligi doimiy ravishda bitta reagent qo'shish orqali nazorat qilinadigan o'lchovdir. Ekvivalentlik nuqtasi - o'tkazuvchanlik birdaniga o'zgargan nuqta. O'tkazuvchanlikning sezilarli o'sishi yoki pasayishi ikkita eng yuqori o'tkazuvchan ionlar, vodorod va gidroksid ionlari kontsentratsiyasining o'zgarishi bilan bog'liq. Bu usulan'anaviy indikatorlar bilan ishlatib bo'lmaydigan rangli eritmalar yoki bir hil suspenziya (masalan, yog'och xamiri suspenziyasi) titrlash uchun ishlatilishi mumkin.
Kislota-asos va oksidlanish-qaytarilish titrlash tez-tez bajariladi, ular yakuniy nuqtani aniqlash uchun umumiy indikatorlardan foydalanadi, masalan, metil apelsin, kislota-ishqor titrlash uchun fenolftalein va yodometrik tipdagi oksidlanish-qaytarilish jarayoni uchun kraxmal eritmalari. Biroq, elektr o'tkazuvchanlik o'lchovlari so'nggi nuqtani aniqlash uchun vosita sifatida ham ishlatilishi mumkin, masalan, kuchli NaOH asosli HCl eritmasini kuzatishda.
Protonni zararsizlantirish
Tirlash jarayonida protonlar suv hosil qilib, NaOH hosil qilish uchun neytrallanadi. NaOH ning har bir qo'shilgan miqdori uchun ekvivalent miqdordagi vodorod ionlari chiqariladi. Haqiqatan ham, mobil H+ kationi kamroq harakatlanuvchi Na+ ioniga almashtiriladi va titrlangan eritmaning o‘tkazuvchanligi hamda o‘lchangan hujayra o‘tkazuvchanligi pasayadi. Bu natriy xlorid NaCl eritmasini olish mumkin bo'lgan ekvivalent nuqtaga kelguncha davom etadi. Agar koʻproq asos qoʻshilsa, koʻproq Na+ va OH- ionlari qoʻshilsa, koʻpayadi va neytrallanish reaksiyasi H+ ning sezilarli miqdorini olib tashlamaydi.

Binobarin, kuchli kislota kuchli asos bilan titrlanganda ekvivalent nuqtada oʻtkazuvchanlik minimumga ega boʻladi. Bu minim altitrlashning oxirgi nuqtasini aniqlash uchun indikator bo'yoq o'rniga ishlatilishi mumkin. Titrlash egri chizig'i qo'shilgan NaOH eritmasi hajmiga bog'liq bo'lgan o'tkazuvchanlik yoki o'tkazuvchanlik qiymatlarining grafigi. Titrlash egri chizig'idan ekvivalentlik nuqtasini grafik tarzda aniqlash mumkin. Konduktometrik tahlil usuli (va undan foydalanish) zamonaviy kimyoda juda dolzarbdir.
Reaktsiya
Kuchsiz kislota-kuchsiz asos oʻrtasidagi reaksiya uchun elektr oʻtkazuvchanligi avvaliga biroz pasayadi, chunki mavjud boʻlgan H+ ionlari kam boʻladi. Keyin ekvivalentlik nuqtasiga erishilgandan so'ng, o'tkazuvchanlik tuz kationi va anionning hissasi tufayli ekvivalentlik nuqtasi hajmiga qadar biroz oshadi (kuchli kislotali asosda bu hissa ahamiyatsiz va u erda hisobga olinmaydi.), o'tkazuvchanlik OH ionlarining ko'pligi tufayli tez ortadi.
Oʻtkazuvchanlik detektorlari (konduktometrik tahlil usuli) suvli eritmalardagi elektrolitlar kontsentratsiyasini oʻlchash uchun ham qoʻllaniladi. Eritmaning o'tkazuvchanligini hosil qiluvchi analitning molyar konsentratsiyasini eritmaning o'lchangan elektr qarshiligidan olish mumkin.
Konduktometrik tahlil usuli: printsip va formulalar
(2.4.13) C=Constcell1Λm1Res, bu erda Constcell o'lchash katakchasiga bog'liq doimiy qiymat, Res - qurilma tomonidan o'lchanadigan elektr qarshiligi (Ohm qonuniga muvofiq Res=I / V va doimiy bilan kuchlanish V o'lchov I intensivligi Res) hisoblash imkonini beradi va Λm ekvivalentdirion zarralari uchun o'tkazuvchanlik. Amaliy maqsadlar uchun m doimiy hisoblanishi mumkin bo'lsa-da, u Kolrausch qonuniga ko'ra konsentratsiyaga bog'liq:
(2.4.14)=Xt Λm0-C, bu yerda D doimiy, Λm0 esa har bir ionning chegaralovchi molyar o’tkazuvchanlik xarakteristikasi. Molar o'tkazuvchanlik o'z navbatida haroratga bog'liq.
Scrit
O’lchov tahlilining konduktometrik usulining rivojlanishi olimlarni yangi kashfiyotlar sari yetakladi. Olimlar CI ionlarining manbai sifatida alkilxlorid gidrolizidan foydalangan holda, Ag+ ionlaridan ortiq bo‘lgan bir hil AgCl cho‘ktirish tizimida kondüktometriyadan foydalangan holda Skritning muhim superto‘yinganlik nisbatini aniqladilar. Ular mos ravishda 15, 25 va 35 ° C da Scrit=1,51, 1,73 va 1,85 ni topdilar, bu erda ularning ta'rifi bo'yicha S=([Ag+][Cl-] / Ksp) 1/2. Agar o'ta to'yinganlik omilining ushbu ta'rifi biznikiga aylantirilsa (S=[Ag+][Cl-] / Ksp), natijalar mos ravishda 2,28, 2,99 va 3,42 ni tashkil qiladi, bu ushbu tadqiqot natijalariga juda mos keladi. Biroq, Skritning haroratga bog'liqligi ushbu tadqiqotda tasvirlanganiga ziddir. Garchi bu qarama-qarshilikning sababi aniq bo'lmasa-da, harorat oshishi bilan Skritning pasayishi juda o'rinli bo'lishi mumkin, chunki yadrolanish tezligi DGm/ kT ning kichik o'zgarishi bilan keskin o'zgaradi va shuning uchun T ga mutanosib bo'lgan DGm/ kT. − 3 (lnSm) 2 (1.4.12) formula bo‘yicha berilgan sistemada harorat o‘zgarishi bilan deyarli o‘zgarmas hisoblanadi. Aytgancha, S ning ta'rifi [Ag +] [Cl -] / Ksp bo'lishi kerak, chunki o'ta to'yinganlik nisbati[AgCl] monomer konsentratsiyasi dastlab S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp sifatida berilgan.
Tanaka va Ivasaki
Tahlilning konduktometrik usuli tarixini ikki taniqli yapon olimlari davom ettirdilar. Tanaka va Ivasaki AgCl va AgBr zarrachalarining yadrolanish jarayonini to'xtatilgan oqim usulidan foydalangan holda ko'p kanalli spektrofotometr bilan birgalikda o'rgandilar, bu msec tartibida tez jarayonni o'rganish uchun foydalidir. Ular 10-4 mol dm-3 tartibli AgC104 eritmasi KX (X=) bilan aralashtirilganda ancha tor UV yutilish zonasiga ega bo'lgan ba'zi o'ziga xos kumush galogenid kompleksi AgXm (m-1) hosil bo'lganligini aniqladilar. Cl yoki Br) 10-2 dan 10-1 mol dm-3 gacha bo'lgan eritma, so'ngra uning 10 ms tez parchalanishi bilan keng ultrabinafsha nurni singdiruvchi va spektrning ancha sekin o'zgarishiga ega bo'lgan oraliq mahsulot hosil bo'ladi. oraliq mahsulotdan. Ular oraliq mahsulotni n molekuladan iborat bo'lgan monodispers yadrolar (AgX) n deb talqin qildilar va C prekursorining turli xil boshlang'ich konsentrasiyalari AgXm (m-1) - (n=7) uchun -dC/dt a Cn ko'rinadigan nisbatdan n ni aniqladilar. AgCl uchun -10, AgBr uchun n=3-4).

Ammo AgXm (m − 1) kashshofi statsionar boʻlmagan tarzda yemirilganligi sababli, kvazstatsionar yadrolanish nazariyasi bu jarayonda qoʻllanilmaydi va shuning uchun n ning natijaviy qiymati mos kelmaydi. kritik yadrolarning nqiymati. Agar oraliq mahsulot monodispers yadrolarni o'z ichiga olsa,monomer kompleksi tomonidan hosil qilingan, -dC / dt a C nisbati saqlanmasligi mumkin. Agar n-merlardan kichikroq klasterlar muvozanatda bo‘ladi deb faraz qilmasak, ki − 1, ici − 1c1=ki, i − 1ci, bir-biri bilan ketma-ket reaksiyada c1 → c2 → c3 →… → cn − 1 → cn., va faqat oxirgi qadam cn - 1 → cn qaytarilmas; ya'ni c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Bundan tashqari, 2 dan n-1 gacha bo'lgan klasterlarning konsentratsiyasi ahamiyatsiz muvozanat konsentratsiyasiga ega deb taxmin qilish kerak. Biroq, bu taxminlarni oqlash uchun hech qanday asos yo'qdek. Boshqa tomondan, biz tez jarayon oxirida kritik yadrolarning radiuslarini va superto'yinganlik koeffitsientlarini S hisoblashga harakat qildik, bunda kub AgCl19 uchun g=101 mJ m - 2 va kub AgBr20 uchun g=109 mJ m - 2, n, AgCl19 uchun 7-10 va AgBr20 uchun 3-4 qiymatlari monodispers yadrolarning o'lchamiga ekvivalent, n. Tekshirishning ma'qullashdan tortib qoyil qolishgacha bo'lgan konduktometrik tahlil usuli kimyoni fan sifatida yangi tug'dirdi.
Natijada olimlar quyidagi formulani topdilar: n=9 boʻlgan AgCl uchun r=0,451 nm va S=105; r=0,358 nm va n=4 bo'lgan AgBr uchun S=1230. Ularning tizimlari 25 °C da taxminan 1,7-2,0 AgCl ning muhim supersaturatsiyasini olgan Devis va Jons tizimlari bilan solishtirish mumkin bo'lganligi sababli. AgNO3 va KCl ning teng hajmdagi suyultirilgan suvli eritmalarida to'g'ridan-to'g'ri aralashtirilgan kondüktometriyadan foydalanganda, juda yuqori S qiymatlari haqiqiy to'yinganlik omillarini aks ettirmasligi mumkin.oraliq yadrolar bilan muvozanatda.
UVni yutish
Keng ultrabinafsha nurlanishiga ega boʻlgan oraliq moddani statsionar boʻlmagan ketma-ket reaksiya natijasida hosil boʻlgan keng oʻlchamli taqsimotga ega oʻrtacha yadrolardan ancha kattaroq deb hisoblash mantiqiyroq koʻrinadi. Oraliq yadrolarning keyingi sekin oʻzgarishi ularning Ostvaldda yetilishi bilan bogʻliq koʻrinadi.

Yuqoridagi kontekstda amerikalik kimyogar Nilsen ham n=dlogJ yordamida supersaturatsiya funksiyasi sifatida loyqalikni oʻlchash natijasida bariy sulfat zarralarining yadrolanishi uchun taxminan 12 nva mos keladigan S 103 dan katta boʻlgan. / dlogC formulaga Becher-Deringga o'xshash nazariya. (1.3.37), lekin no'rniga (n+ 1) berish. Ushbu tajribada bariy ionlari va sulfat ionlarining eritmalari to'g'ridan-to'g'ri aralashtirilganligi sababli, tez o'tkinchi yadro hosil bo'lishi aralashtirilgandan so'ng darhol tugashi kerak edi va o'lchangan narsa Ostvaldning keyingi sekin pishishi va / yoki hosil bo'lgan yadrolarning birlashishi tezligi bo'lishi mumkin. Ko'rinishidan, bu nning asossiz darajada kichik qiymati va o'ta yuqori to'yinganlik sababidir. Shuning uchun biz yana bir bor ta'kidlashimiz kerakki, monomer turlarining ba'zi bir rezervuari, ularni iste'mol qilishiga javoban ularni chiqaradigan har doim yopiq tizimda kvazi-statsionar yadrolanishga erishish uchun zarurdir. Yadrolanishning barcha klassik nazariyalari, shu jumladan Bexer-Döring nazariyasi, bunday shartni bilvosita qabul qiladi. Konduktometrik ta'riftahlil usuli yuqoridagi maqola bo'limlarida berilgan.
Boshqa olimlar metilen galogenid va kumush ionlarini o'z ichiga olgan suvning impulsli radiolizi yo'li bilan kumush galogenidning vaqtincha yadrolanishi jarayonini o'rgandilar, bu jarayonda metilen galogenid diapazonda impulsli nurlanish natijasida hosil bo'lgan gidratlangan elektronlar tomonidan galogenid ionlarini chiqarish uchun parchalanadi. 4 ns dan 3 ms gacha. Mahsulotlar spektrlari fotoko'paytiruvchi va chiziqli kamera yordamida qayd etildi va monomer kumush galogenid prekursorlari vaqt o'tishi bilan mikrosekundlar tartibida hosil bo'lishi aniqlandi, keyin Tanaka va Ivasaki kuzatganiga o'xshash yadrolanish jarayoni kuzatildi. Ularning natijalari aniq ko'rsatadiki, kumush galogenidlarini reaksiyaga kirishuvchi moddalarni bevosita aralashtirish orqali yadrolanish jarayoni ikki elementar bosqichdan iborat; ya'ni ms tartibli monomer prekursorning hosil bo'lishi va keyinchalik 10 ms tartibli yadrolarga o'tishi. Shuni ta'kidlash kerakki, yadrolarning o'rtacha kattaligi taxminan 10 nm.
Toʻyinganlik
AgNO3 va KCl kabi reaktivlarning yuqori konsentratsiyasi yog'ingarchilik davomida jelatin eritmasiga doimiy ravishda kiritiladigan ochiq tizimlarda AgCl zarrachalarining yadrolanishi uchun o'ta to'yinganlik koeffitsientlariga kelsak, Strong va Wey31 1,029 (80° C) - 1.260 (40 ° C) va Leubner32 tanqidiy supersaturatsiyada AgCl urug'i zarralarining o'sish tezligini o'lchash natijasida 60 ° C da 1.024 ni qayd etdi. Miqdoriy tahlilning konduktometrik usulining mohiyati shundan iborat.
Boshqa tomondan, ochiq AgBr zarracha tizimlari uchun ba'zikritik o'ta to'yinganlik koeffitsientining taxminiy qiymatlari, Scrit: Scrit∼- 1,5 da 70 °C da Wey va Strong33 bo'yicha KBr ga AgNO3 eritmasini qo'shishning turli tezligida renukleatsiya chegarasini topish yo'li bilan aniqlangan o'lchamga bog'liq maksimal o'sish tezligidan. urug 'zarralari mavjud bo'lganda qo'sh jet orqali eritma; Skrit=1,2-1,5 25 ° C da Jagannathan va Wey34 bo'yicha maksimal o'ta to'yinganlik omili sifatida Gibbs-Tomson tenglamasidan ularning ma'lumotlari bilan ikki reaktiv AgBr yog'ingarchilikning yadrolanish bosqichida elektron mikroskop tomonidan kuzatilgan yadrolarning minimal o'rtacha hajmi to'g'risidagi ma'lumotlar.. Bu kondüktometrik miqdorni aniqlash usulini qo'llashda juda samarali.

Ushbu Skrit qiymatlarini hisoblashda ular g=140 mJ m − 2 ni oldi. Ochiq tizimlarda yadrolanish reaktiv chiqish joylari yaqinidagi oʻta yuqori toʻyingan mahalliy zonada hosil boʻlgan yangi tugʻilgan yadrolarning omon qolish jarayoniga toʻgʻri kelgani uchun kritik. supersaturatsiya maksimal kattalikdagi yadrolar bilan muvozanatdagi erigan moddaning kontsentratsiyasiga to'g'ri keladi, agar biz AgBr yadrolarining maksimal radiusi bo'yicha Sugimoto35 ma'lumotlarini kub AgBr (=109 mJ m -2) uchun nazariy g bilan ochiq tizimlarda (.3 8,3 nm) ishlatsak.) 3 bo'lsa, kritik o'ta to'yinganlik koeffitsienti, Skrit, 25°C da 1,36 ga teng bo'lib hisoblanadi (agar g 140 mJ/m2 deb qabul qilinsa, u holda Skrit=1,48).
Binobarin, har qanday holatda ham kritik supersaturatsiyalarkumush halid zarrachalarining ochiq tizimlari odatda yopiq tizimlarda maksimal supersaturatsiyadan ancha past (ehtimol kritik supersaturatsiyalarga yaqin). Buning sababi shundaki, ochiq tizimning mahalliy zonasida hosil bo'lgan yadrolarning o'rtacha radiusi yopiq tizimdagi rmdan ancha katta, ehtimol, ochiq tizimning mahalliy zonasida yuqori konsentratsiyali birlamchi yadrolarning bir lahzada birlashishi bilan bog'liq. mahalliy elektrolitlar konsentratsiyasi.
Ilova
Enzimatik jarayonlar davomida uzluksiz qayd qilish uchun konduktometrik titrlash usulidan foydalanish keng miqyosda o'rganilgan va tahlil qilingan. Deyarli barcha elektrokimyoviy analitik usullar elektrokimyoviy reaksiyalarga asoslanadi (potentsiometriya, voltametriya, amperometriya, kulometriya).
Tahlilning konduktometrik usuli - elektrodlarda elektrokimyoviy reaksiyalar umuman bo'lmagan yoki e'tiborsiz qolishi mumkin bo'lgan ikkilamchi reaktsiyalar mavjud bo'lgan usul. Shuning uchun bu usulda chegara qatlamidagi elektrolit eritmasining eng muhim xususiyati uning elektr o'tkazuvchanligi bo'lib, u biologik reaksiyalarning yetarlicha keng doirasiga qarab o'zgaradi.
Foydalar
Konduktometrik biosensorlar boshqa turdagi transduserlarga nisbatan ham bir qancha afzalliklarga ega. Birinchidan, ular arzon narxlardagi nozik kino standart texnologiyasi yordamida amalga oshirilishi mumkin. Bu biologik materialni immobilizatsiya qilishning optimallashtirilgan usulini qo'llash bilan bir qatorda qurilmalarning birlamchi narxini sezilarli darajada kamaytirishga olib keladi.tahlilning umumiy qiymati. O'rnatilgan mikrobiosensorlar uchun differensial o'lchash rejimini bajarish oson, bu tashqi ta'sirlarni qoplaydi va o'lchov aniqligini sezilarli darajada yaxshilaydi.
Ma'lumotlar konduktometrik biosensorlarning katta imkoniyatlarini aniq ko'rsatib turibdi. Biroq, bu hali ham biosensorlarda juda yangi tendentsiya, shuning uchun tijorat qurilmalarini yaratish istiqbolli kelajakka ega.
Yangi usullar
Ba'zi olimlar o'tkazuvchanlik bo'yicha pKa ni o'lchashning umumiy usulini ta'riflagan. Bu usul taxminan 1932 yilgacha (pH o'lchash usullari qo'llanilgunga qadar) keng qo'llanilgan. Konduktometrik usul haroratga juda sezgir va pKa qiymatlarini bir-biriga yopishgan holda o'lchash uchun foydalanilmaydi. Xromoforsiz namunalar uchun mumkin bo'lgan afzallik shundaki, u 2,8 × 10-5 M gacha bo'lgan juda suyultirilgan eritmalarda qo'llanilishi mumkin. So'nggi yillarda lidokainning pKa ni o'lchash uchun kondüktometriya 87 qo'llanilgan, ammo olingan natija 0,7 bo'lgan. umumiy qabul qilingan pH qiymatidan past birlik uchun.

Albert va Serjant eruvchanlik o'lchovlaridan pKa ni aniqlash usulini ham tasvirlab berdilar. Yuqorida aytib o'tilganidek, eruvchanlik pKa ga bog'liq, shuning uchun agar eruvchanlik egri chiziqda bir nechta pH qiymatlarida o'lchansa, pKa aniqlanishi mumkin. Pek va Benet eruvchanlik va pH o'lchovlari to'plamini hisobga olgan holda monoprotik, diprotik va amfoter moddalar uchun pKa qiymatlarini baholashning umumiy usulini tasvirlab berdi. Xansen va Xafliger namunaning pKa ni oldi, buaylanadigan diskli qurilmada pH funktsiyasi sifatida dastlabki erish tezligidan gidroliz orqali tez parchalanadi. Natija pH/UV natijasi bilan yaxshi mos keladi, ammo parchalanish ikkinchi usulni qiyinlashtiradi. Bu, umuman olganda, konduktometrik tahlil usulining tavsifidir.






